关于作者
辛勤,男, 研究员,博士生导师,催化基础国家重点实验室学委会副主任(1992-1997),中国化学会催化专业委员会秘书长(1994-2009),石油炼制学会催化剂分子筛学组副组长(1993-1996),《光谱与光谱分析》,《分子催化》,《功能材料》,《工业催化》杂志编委,Applied Science,Electrochemistry Acta 客座编辑。第一批国务院政府津贴获得者。主要研究领域:直接醇燃料电池及电极催化剂制备规律研究;过渡金属氮化物,碳化物催化剂研究;纳米发光材料、固体催化剂的原位表征研究等

酶催化反应
辛勤
2014年07月16日
许多化学反应都需要催化剂的参与,这些具有催化活性的物质可以降低反应所需的活化能,显著地改变化学反应速率,且反应后自身不发生变化。在生物体中发生的化学反应几乎全都需要催化剂的参与,但这些催化剂不是分子筛,也不是金属络合物,而是能够影响反应中心的化学键的断裂,稳定过渡态的蛋白质、核酸及其复合物的物质。这种具有生物催化功能的高分子物质被称为酶[1]。酶在生物体中和细胞的其它组成及来源没有区别,是具有生物活性的功能物质。
核酸被发现具有催化功能是在二十世纪八十年代,Cech和Altman因对RNA催化剂研究的突出贡献,共获1989年度诺贝尔化学奖。一般而言,我们把在细胞中起催化作用的蛋白称为酶,酶在字典中被解释为“一种有机的胶状物质,由蛋白质组成,对于生物化学变化起催化作用,发酵就是靠它的作用,又称酵素。”
发酵是我们非常熟悉的过程,做馒头需要面粉发酵,而发酵就是最早的酶的利用。在公元前21世纪,中国的夏禹时代和古巴比伦都已经有酿酒的记载,酿酒就是用酒曲把粮食中的淀粉转变为酒精,酒曲中含有丰富的微生物,如霉菌、细菌、酵母菌、乳酸菌等,霉菌中有曲霉菌、根霉菌、毛霉菌等有益的菌种,其本质就是提供酿酒用各种酶的载体。“曲为酒之母,曲为酒之骨,曲为酒之魂”,这是酶在酿酒这一复杂的化学转化过程中所处的地位的高度概括。
酶在民间一直被广泛使用。其实在公元前12世纪的周代,人们就开始利用酶制作饴糖,但是我们的祖先并不知道酶是什么物质。对于这种具有神奇能力的物质的认识仅仅限于生活经验水平,而缺少对于酶的本质了解。我们知道任何物质都是结构决定性质,从表观的性质来帮助我们认识结构的特殊性,而酶这种天然的催化剂也不例外。
18世纪晚期,西方国家开始了对酶的探索。1783年,意大利科学家Spallanzani发现鸟的胃液能分解消化肉类,虽然他未说明此物为酶,但后来还是有人把他看作是酶的最早发现者。1833年,Payen等从麦芽水提取物中,用酒精沉淀获得了一种对热不稳定的物质,他可以使淀粉水解为可溶性糖,这种物质被称为淀粉酶制剂,也是一种游离于细胞代谢活动之外的制剂,它可以完成特定的化学反应,但是当温度过高时,它可能会失去此特性,Payen等的发现表明人们开始认识到酶的一些特点。直到1897年,德国化学家Buchner兄弟把酵母细胞放在石英砂中用力研磨,加水搅拌,再进行加压过滤,得到不含酵母的提取液,在这些汁液中加入葡萄糖,一段时间后就冒出气,糖液居然变成了酒,证明了不含细胞的酵母提取液也能使糖发酵,说明发酵与细胞的活动无关,而是酶作用的化学本质,为此Bucher获得了1911年诺贝尔化学奖。1898年,Duelaux提出引用?“ase”作为酶命名的词根。在酶这个概念传人中国时,人们用“酉”与“每”结合起来表示这一概念,“每”意为“自身生长出来并遍布于表面的物质”,“酉”指“发酵腐败”等最初发现的酶促反应。这也表现了当这个概念传入中国时人们对酶的认识。
随着科技的发展,人们逐渐认识到酶在化学反应中的重要地位,那么酶作为生物催化剂的特点又是什么呢?
酶催化的反应条件温和,反应专一、高效,容易失活。
较好地解释了酶的立体结构的专一性,但却不能解释酶的专一性中的所有现象。直到1903年,Henri在研究蔗糖酶水解蔗糖的反应中发现酶与底物之间存在某种关系,提出酶与底物的作用是通过酶与底物生成络合物而进行的,并提出了酶与底物作用的中间复合物学说,这是从分子水平最早对酶作用机制的探讨,开始从酶结构的本质来认识酶的功能。1913年Michaelis和Menten根据中间络合物学说,导出了著名的Michaelis-?Menten方程,奠定了酶动力学的最早基础。1958年Koshland提出酶-底物反应的诱导契合模型[2]。该模型认为酶和底物结合时,结合力促使酶和底物分别发生一些构象变化,从而更有利于催化反应的发生(如图2),后来科学家对羧肽酶等进行了X射线衍射研究,研究的结果有力地支持了这个学说。60-70年代科学家们又提出了别构理论及酶活性调节的相关理论,与此同时,Clealand发展了多底物多产物的酶动力学原理和公式,20世纪成为酶学理论的快速发展期。进入20世纪后,由于各种技术取得了突飞猛进的发展,为认识酶特性的本质提供了可能。具体而言,就是我们有了能够“看到”酶(蛋白)这样的大分子的结构的工具。
由于酶是蛋白质大分子,维持大分子的结构就是保证酶催化功能的基础,酶所处的环境发生变化,酶就会失活,这是由于其分子结构发生了变化;酶作为大分子,其结构除与氨基酸残基的性质相关外,同时与大分子内空间缠绕所形成的特定形状结构有关,而这种独特形状的结构则决定了它的选择性即专一性及其高效性,因此任何可以使酶的结构发生变化的环境都有可能使酶失去催化功能,如高温、强酸、强碱。
随着对蛋白质的序列即分子组成到蛋白质的折叠成二级结构再到空间三维结构的认识,人们对蛋白催化功能的研究也更加深入,1963年,科学家们测定了第一例蛋白酶的氨基酸顺序。用X射线研究蛋白质的结构也在数十年间得到极大发展,1965年Phiitips首次用X射线衍射技术阐明了鸡蛋清溶菌酶的三维结构。时至今日,酶三维结构结构的研究已经成为了常规手段,相应的技术包括X射线晶体衍射、NMR以及冷冻电镜,这为在分子水平上深入了解酶的构象与功能的关系提供了可能。
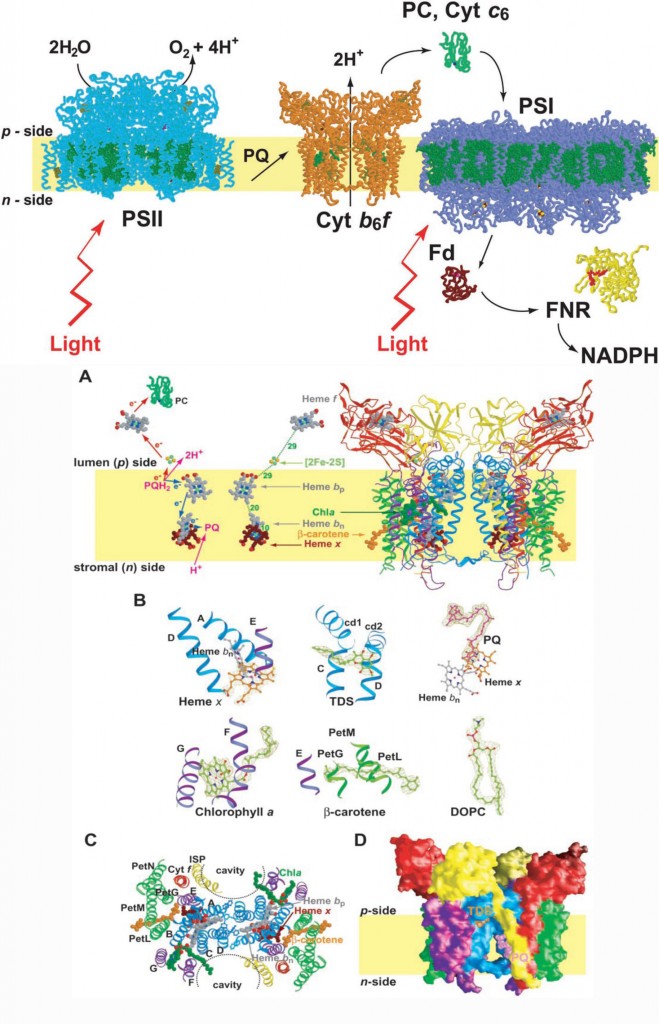
下图是细胞色素b6f复合物的结构,这个结构展现了我们所知道的光合作用中细胞色素b6f在光系统I和II之间起的电子传递的连接作用、光合放氧的过程以及为合成ATP质子梯度的形成。所有的这些反应都是在酶催化下进行的,图3告诉我们这些反应怎样进行的,左边是示意图,右边是结构图。
作为自然界的一部分,人的行为活动应该与自然友好,为了实现这一目标,大力发展“酶”化工是必然途径。在认识更多酶的性质基础上,要使得酶的应用参与人的活动的各个方面。
核酸被发现具有催化功能是在二十世纪八十年代,Cech和Altman因对RNA催化剂研究的突出贡献,共获1989年度诺贝尔化学奖。一般而言,我们把在细胞中起催化作用的蛋白称为酶,酶在字典中被解释为“一种有机的胶状物质,由蛋白质组成,对于生物化学变化起催化作用,发酵就是靠它的作用,又称酵素。”
发酵是我们非常熟悉的过程,做馒头需要面粉发酵,而发酵就是最早的酶的利用。在公元前21世纪,中国的夏禹时代和古巴比伦都已经有酿酒的记载,酿酒就是用酒曲把粮食中的淀粉转变为酒精,酒曲中含有丰富的微生物,如霉菌、细菌、酵母菌、乳酸菌等,霉菌中有曲霉菌、根霉菌、毛霉菌等有益的菌种,其本质就是提供酿酒用各种酶的载体。“曲为酒之母,曲为酒之骨,曲为酒之魂”,这是酶在酿酒这一复杂的化学转化过程中所处的地位的高度概括。
酶在民间一直被广泛使用。其实在公元前12世纪的周代,人们就开始利用酶制作饴糖,但是我们的祖先并不知道酶是什么物质。对于这种具有神奇能力的物质的认识仅仅限于生活经验水平,而缺少对于酶的本质了解。我们知道任何物质都是结构决定性质,从表观的性质来帮助我们认识结构的特殊性,而酶这种天然的催化剂也不例外。
18世纪晚期,西方国家开始了对酶的探索。1783年,意大利科学家Spallanzani发现鸟的胃液能分解消化肉类,虽然他未说明此物为酶,但后来还是有人把他看作是酶的最早发现者。1833年,Payen等从麦芽水提取物中,用酒精沉淀获得了一种对热不稳定的物质,他可以使淀粉水解为可溶性糖,这种物质被称为淀粉酶制剂,也是一种游离于细胞代谢活动之外的制剂,它可以完成特定的化学反应,但是当温度过高时,它可能会失去此特性,Payen等的发现表明人们开始认识到酶的一些特点。直到1897年,德国化学家Buchner兄弟把酵母细胞放在石英砂中用力研磨,加水搅拌,再进行加压过滤,得到不含酵母的提取液,在这些汁液中加入葡萄糖,一段时间后就冒出气,糖液居然变成了酒,证明了不含细胞的酵母提取液也能使糖发酵,说明发酵与细胞的活动无关,而是酶作用的化学本质,为此Bucher获得了1911年诺贝尔化学奖。1898年,Duelaux提出引用?“ase”作为酶命名的词根。在酶这个概念传人中国时,人们用“酉”与“每”结合起来表示这一概念,“每”意为“自身生长出来并遍布于表面的物质”,“酉”指“发酵腐败”等最初发现的酶促反应。这也表现了当这个概念传入中国时人们对酶的认识。
随着科技的发展,人们逐渐认识到酶在化学反应中的重要地位,那么酶作为生物催化剂的特点又是什么呢?
酶催化的反应条件温和,反应专一、高效,容易失活。
图1 酶催化的锁钥模型
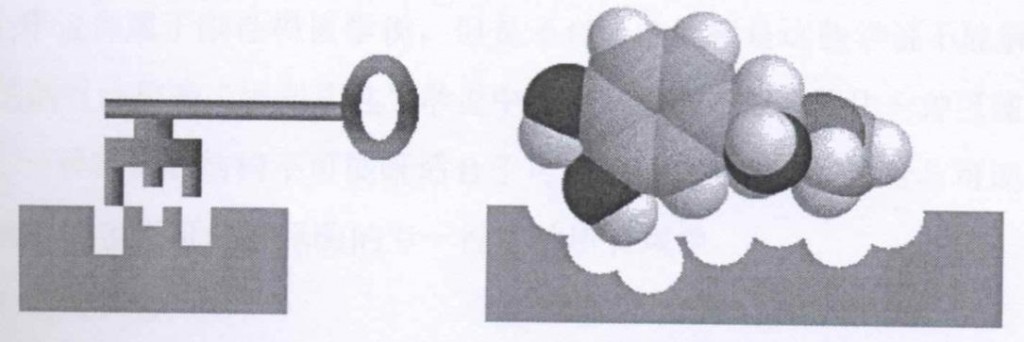
酶在细胞内和细胞外的反应通常都不需要高温,而高温经常使酶失活。对于酶的反应专一性,在1894年,德国化学家Emil?Fisher提出了酶与底物分子作用的锁钥学说(如图1),
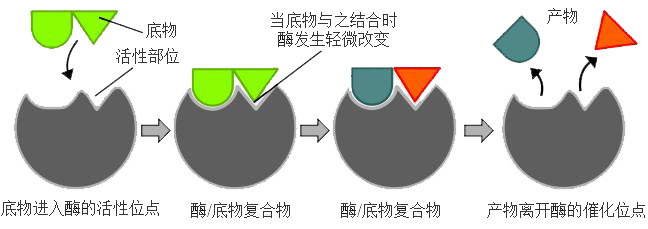
较好地解释了酶的立体结构的专一性,但却不能解释酶的专一性中的所有现象。直到1903年,Henri在研究蔗糖酶水解蔗糖的反应中发现酶与底物之间存在某种关系,提出酶与底物的作用是通过酶与底物生成络合物而进行的,并提出了酶与底物作用的中间复合物学说,这是从分子水平最早对酶作用机制的探讨,开始从酶结构的本质来认识酶的功能。1913年Michaelis和Menten根据中间络合物学说,导出了著名的Michaelis-?Menten方程,奠定了酶动力学的最早基础。1958年Koshland提出酶-底物反应的诱导契合模型[2]。该模型认为酶和底物结合时,结合力促使酶和底物分别发生一些构象变化,从而更有利于催化反应的发生(如图2),后来科学家对羧肽酶等进行了X射线衍射研究,研究的结果有力地支持了这个学说。60-70年代科学家们又提出了别构理论及酶活性调节的相关理论,与此同时,Clealand发展了多底物多产物的酶动力学原理和公式,20世纪成为酶学理论的快速发展期。进入20世纪后,由于各种技术取得了突飞猛进的发展,为认识酶特性的本质提供了可能。具体而言,就是我们有了能够“看到”酶(蛋白)这样的大分子的结构的工具。
图 2 酶催化的诱导契合模型
1926年,James?Sumner首次从刀豆提取液中分离得到脲酶结晶,证明它具有蛋白质的性质,首次提出酶的本质是蛋白质的观点,从分子水平认识了酶。1930-1936年Northrop和Kunitz也对多种酶进行结晶并证实酶是一种蛋白质后,人们就普遍接受了此观点,为此Summer与Northrop于1949年共同获得了诺贝尔化学奖。
由于酶是蛋白质大分子,维持大分子的结构就是保证酶催化功能的基础,酶所处的环境发生变化,酶就会失活,这是由于其分子结构发生了变化;酶作为大分子,其结构除与氨基酸残基的性质相关外,同时与大分子内空间缠绕所形成的特定形状结构有关,而这种独特形状的结构则决定了它的选择性即专一性及其高效性,因此任何可以使酶的结构发生变化的环境都有可能使酶失去催化功能,如高温、强酸、强碱。
随着对蛋白质的序列即分子组成到蛋白质的折叠成二级结构再到空间三维结构的认识,人们对蛋白催化功能的研究也更加深入,1963年,科学家们测定了第一例蛋白酶的氨基酸顺序。用X射线研究蛋白质的结构也在数十年间得到极大发展,1965年Phiitips首次用X射线衍射技术阐明了鸡蛋清溶菌酶的三维结构。时至今日,酶三维结构结构的研究已经成为了常规手段,相应的技术包括X射线晶体衍射、NMR以及冷冻电镜,这为在分子水平上深入了解酶的构象与功能的关系提供了可能。
下图是细胞色素b6f复合物的结构,这个结构展现了我们所知道的光合作用中细胞色素b6f在光系统I和II之间起的电子传递的连接作用、光合放氧的过程以及为合成ATP质子梯度的形成。所有的这些反应都是在酶催化下进行的,图3告诉我们这些反应怎样进行的,左边是示意图,右边是结构图。
图三
酶作为一种天然的催化剂,最初以细胞为载体出现并被认识和应用,20世纪后可以用纯酶直接进行催化反应并应用。目前发现的酶已有近万种,其应用范围也愈来愈广泛,比如有机合成,食品工业,纺织、制革,日用化学,农业生产,疾病治疗,环境保护,能源开发等领域[3]。我国首次应用于工业生产中的酶是1965年无锡酶制剂厂生产BF-7658淀粉酶,首先用在淀粉加工和纺织退浆上,但是从酶的使用量来看,到目前为止,酶的主要应用仍然是衣用洗涤剂行业,这方面的用量约占酶总量的30~40%。
作为自然界的一部分,人的行为活动应该与自然友好,为了实现这一目标,大力发展“酶”化工是必然途径。在认识更多酶的性质基础上,要使得酶的应用参与人的活动的各个方面。