关于作者
辛勤,男, 研究员,博士生导师,催化基础国家重点实验室学委会副主任(1992-1997),中国化学会催化专业委员会秘书长(1994-2009),石油炼制学会催化剂分子筛学组副组长(1993-1996),《光谱与光谱分析》,《分子催化》,《功能材料》,《工业催化》杂志编委,Applied Science,Electrochemistry Acta 客座编辑。第一批国务院政府津贴获得者。主要研究领域:直接醇燃料电池及电极催化剂制备规律研究;过渡金属氮化物,碳化物催化剂研究;纳米发光材料、固体催化剂的原位表征研究等

不对称催化与手性现象
辛勤
2014年07月16日朱付林,张德旸,胡向平
中科院大连化物所
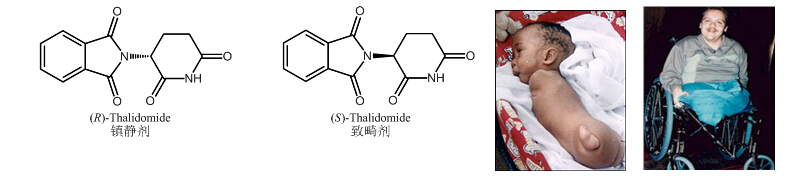
引言药物与人们的生活息息相关,在疾病日益多发的时代,药物是我们生命健康的安全保障,而大部分的药物都是手性药物。据统计,全世界已经上市销售的药物总数约有1850?种,?其中天然及非合成药物(523?种)中有99%为手性药物,合成药物(1327?种)中有40%为手性药物。关于手性药物的重要性可以通过一个故事来说明:上世纪60年代前后,很多妊娠妇女通过服用一种叫做沙利度胺(Thalidomide,反应停)的药物来镇痛和止咳,治疗效果很好,但是随即而来的结果是,不少妇女生下的婴儿都是短肢畸形的怪胎。这是为什么呢?其实这种合成药物是有手性的,它是两种对映体的混合物,这种药的右旋体的确有镇静作用,但是它的左旋体却有着强烈的致畸作用。当时人们并没有发现这个问题,结果酿成了惨痛的悲剧。据统计,这一悲剧事件导致了一万两千多名畸形儿的诞生。沉痛的教训惊醒了人们,也使人们对手性以及它与生命的关系有了更深刻的认识。 一.手性现象简介
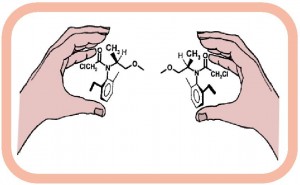
那么什么是手性呢?不知道大家有没有注意到生活中的一个有趣现象,就是无论你怎么摆姿势,都无法将自己的左手和右手重合。但当你照镜子的时候你就会发现,你的左手在镜子里的像刚好跟你的右手重合。我们把这种有趣的现象叫做手性——即如果一个物体不能跟自己的镜像重合,我们就说这个物体具有手性。
在自然界中手性现象广泛存在。例如喇叭花的缠绕方向就是手性的,把右旋的喇叭花强行左旋缠绕,它会自动恢复成右旋的状态;动物中的海螺同样是右旋世家,出现左旋海螺的概率是百万分之一;同样组成我们生命体基本单位的氨基酸也具有手性,除了极少数生物体内存在右旋氨基酸外,组成地球生命体的几乎都是左旋氨基酸;另外,供给人体能量的葡萄糖也都是右旋的,绝大多数生物遗传的物质基础DNA也是以右旋方式相互缠绕而成的双螺旋结构。这里举出的许多例子表明,手性是许多物体的一项重要特点。 在化学领域中,手性现象同样广泛存在,而有机分子的手性通常是由不对称碳引起的。在一个有机分子中,碳原子通过共价键能与四个其它原子或基团相连。当相连的四个原子或基团互不相同时,就会产生手性,我们称该有机分子为手性分子。两个互为镜像的手性分子构成一对对映异构体。互为对映异构体的两个手性分子在原子组成上完全一致,它们的许多宏观物理性质如熔点、沸点、溶解性等,甚至许多微观化学反应性能也完全相同。我们通常是通过手性分子的光学特征对其识别的。例如,如果手性分子所配成的溶液能使平面偏振光按顺时针方向旋转,我们就称这个对映体为右旋体,记作(+)或者D;相反能使平面偏振光按逆时针方向旋转的对映体,我们称之为左旋体,记作(-)或者L。当等量的对映体分子混合在一起时,不会引起平面偏振光的旋转,我们称之为外消旋体。
二.?不对称催化起源及作用机理
长期以来,人们主要从自然界获取手性化合物。但随着现代社会对手性化合物需求的急剧增加,天然手性化合物无论从种类还是数量上都已远远不能满足这一需求,利用化学方法获取手性化合物就成了必然的选择。但人们在进行化学合成时,往往得不到单一的同手性物质,而会得到一对对映体的等量混和物,即上面提到的外消旋体。对于医药公司而言,他们每生产一次药物都要费劲周折,通过拆分等方法,把其中占一半含量的无效对映体给分离出来。如果无法找到这一半对映体的利用价值,那它们就是废物,既增加了成本,又浪费了资源。在这种背景下,怎样高效地、高选择性地用化学方法合成我们所需的绝对构型的手性化合物,便成为了一个急需解决的科学问题。
在这一背景下,“不对称催化”应运而生。不对称催化是指在少量不对称催化剂的诱导下,高效率地获得手性分子的不对称合成反应,它的神奇之处就在于“可以实现用少量手性催化剂获得到大量的手性化台物,实现手性增殖,是最经济的方法”。这种方法的核心是手性催化剂。
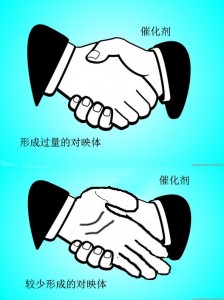
那么手性的催化剂是如何在反应过程中诱导生成手性分子的呢?它的作用机理是这样的:在化学反应中,不对称催化剂先和一种底物结合,然后进攻另一种反应物,这时它有两个方向可以接近反应位点,但由于不对称催化剂的空间结构以及电子云的影响,导致了从一个方向进攻时的能量要比从另一个可能的方向低,最终使产物中一种对映体的量超过另外一种。这个过程也可以用握手来形象地解释:当你伸出右手去和对方握手时,对方用右手要比用左手配合更好,而你的右手就好比神奇的手性催化剂。
三.不对称催化的发展
不对称催化因为其独特的优势成为手性合成中极具吸引力和最富挑战性的研究方向,过去几十年的时间里吸引了很多优秀的科学家投身这一领域。其中三位科学家诺尔斯、野依良冶和夏普莱斯因为在该领域里的开创性工作,分享了2001年的诺贝尔化学奖。1968年,美国孟山都的诺尔斯将手性膦配体与铑金属配合物组成的手性催化剂成功地用于取代苯乙烯的不对称催化氢化反应中,实现了不对称催化反应中首例高对映选择性合成,成为不对称催化反应研究的里程碑。后来,该方法被孟山都公司成功地应用于治疗帕金森病的药物——手性多巴胺的合成中。诺尔斯的成功也极大地鼓励了投身于不对称催化这一研究领域的后来者,而探索催化效果更好的手性催化剂也成为了研究热点。上世纪八十年代,日本科学家野依良冶等在诺尔斯的基础上开发出了一种被称作BINAP的手性化合物,它和金属配位生成的手性催化剂能够将烯烃100%的不对称还原成手性分子.达到了像酶一样的催化效率,这也成为不对称催化发展史上的又一次历史性飞跃。随后,野依良冶将不对称催化还原应用到衣康酸、脱氢二肽、薄荷醇、降冰片二烯等萜烯类以及某些抗生素药物的合成中,并和日本高砂香料工业株式会社合作,使薄荷醇等合成天然香精得以工业化的规模生产。而美国科学家夏普莱斯在上世纪八十年代用手性钛酸酯及过氧叔丁醇成功地实现了烯丙醇不对称环氧化反应,这一合成方法被看作是不对称催化氧化的经典合成,人们称之为“Sharp1ess反应”。由该方法合成的中间体被广泛地应用于制备其他手性化合物中,如著名的治疗心脏病的药物“ -阻断剂”。
目前,不对称催化的研究已经取得到了长足的进展,各类重要的有机反应都相继发展了有效的催化体系,数以万计的配体被合成和应用。除了金属配合物催化,科学家们在不对称催化领域中还发展了有机小分子催化、酶催化的方法,这些方法也都取得了丰富的研究成果。如美国孟山都(Monsanto)公司使用[Rh(COD)2]BF4作为金属盐,手性双膦DIPAMP为配体来还原烯酰胺底物,得到了ee(对映体过量)值超过90%的手性多巴胺,反应底物与催化剂的比例达到20000:1,从而实现了这一药物的工业化生产。瑞士圣克鲁斯生物技术(solvias)公司和先正达(syngenta)公司开发了铱-二茂铁基双膦配体(xyliphos)催化体系并将其用于高位阻亚胺的不对称氢化中,实现了除草剂金都尔(主要成分是异丙甲草胺)的工业化生产:在氢气压力80?bar、反应温度50 的条件下,能得到大于1,000,000的TON(转换数),生产量大于10000吨/年。瑞士罗氏(Roche)公司用钌-双瞵配体(BIPHEP型)为催化体系还原烯丙基醇,在侧链类异戊二烯上产生了两个手性中心,从而实现了(R,R,R)-a-生育酚(具有极高的维生素E活性)的不对称合成,底物与催化剂比例可达150000:1。瑞士龙沙(lonza)公司开发的全细胞生物催化工艺,可以用来生产L-卡尼汀(肉碱),该路径类似脂肪酸的 -氧化反应,由巴豆基甜菜碱基-CoA-水解酶引入手性中心。德国德固赛(degussa)公司开发了用亮氨酸脱氢酶和甲酸脱氢酶为催化剂,以 -酮酸为起始底物,经还原氨基化作用生产ee?>?99%的L-叔亮氨酸的工艺。法国罗地亚(Rhodia)公司开发了用手性Salen-Co(III)配合物催化外消旋末端环氧化合物Jacobsen,并通过水解动力学拆分生产环氧氯丙烷的工艺。另外,不对称催化技术在手性醇、氯代醇、胺、(磺酸)酯、羟基酸、环丙烷酸、硫醚等重要药物的中间体和非天然氨基酸、生物素等的合成中都得到了实质性的应用。总之,不对称催化合成已应用到几乎所有的有机反应类型中。 四.不对称催化的挑战与展望
不对称催化合成研究现在依然处在方兴未艾的发展阶段,许多与手性相关的科学问题还有待解决。例如,手性催化剂大部分只对特定的反应、甚至特定的底物有效,没有广泛适用的手性催化剂,而且多数手性催化剂的转化数较低,稳定性不高,难以回收和重复使用。因此,如何设计合成高效、新型的手性催化剂,探讨配体和催化剂设计的规律,解决手性催化剂的选择性和稳定性,以及研究手性催化剂的设计、筛选、负载和回收的新方法是不对称催化研究领域面临的新挑战。目前国际学术界关注着以下三个方面的发展:
1)?寻找更高催化活性的手性配体和催化剂;
2)?开拓新的不对称催化反应方法;
3)?开发具有经济价值的工业规模工艺。
21世纪无疑是手性技术的世纪,我们相信不对称催化将继续成为研究的热点,并发挥更大的力量,从而对人类的发展以及生命健康做出贡献。